Proceso politrópico
Un proceso politrópico es un proceso termodinámico que ocurre cuando la relación entre la presión P y el volumen V dada por P.Vn se mantiene constante. El exponente n es un número real, generalmente comprendido entre cero e infinito, pero que en algunos casos puede ser negativo.
El valor de n recibe el nombre de índice de politropía y es importante resaltar que durante un proceso termodinámico politrópico dicho índice debe mantener un valor fijo, de lo contrario el proceso no se considerará politrópico.
Características de los procesos politrópicos
Algunos casos característicos de procesos politrópicos son:
– El proceso isotérmico (a temperatura T constante), en el que el exponente es n=1.
– Un proceso isobárico (a presión P constante), en este caso n=0.
– El proceso isocórico (a volumen V constante), para el cual n=+∞.
– Los procesos adiabáticos (a entropía S constante), en los cuales el exponente es n=γ, siendo γ la constante adiabática. Esta constante es el cociente entre la capacidad calorífica a presión constante Cp dividido entre la capacidad calorífica a volumen constante Cv:
γ=Cp/Cv
– Cualquier otro proceso termodinámico que no sea alguno de los casos anteriores. pero que cumpla P.Vn = ctte con índice politrópico real y constante n será también un proceso politrópico.
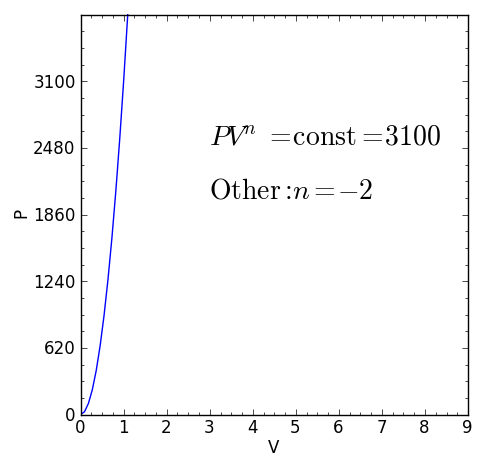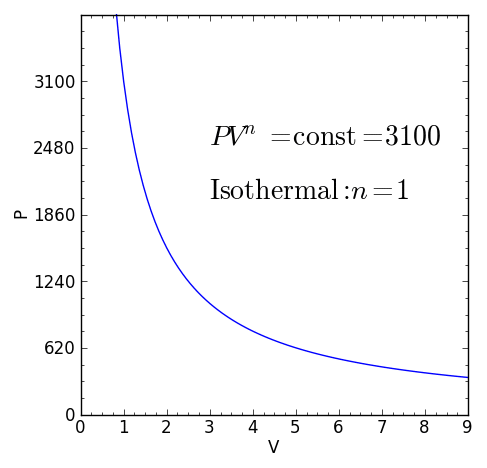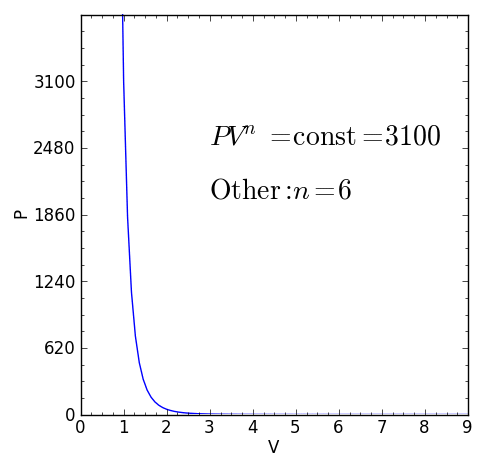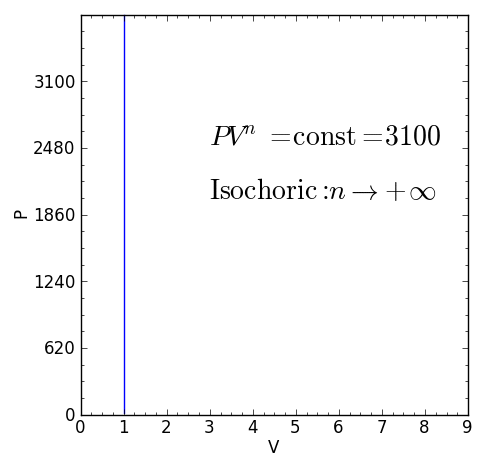
Ejemplos de procesos politrópicos
– Ejemplo 1
Suponga un cilindro con un pistón movible lleno con un kilogramo de aire. Inicialmente el aire ocupa un volumen V1= 0,2 m3 a una presión P1= 400 kPa. Se sigue un proceso politrópico con n=γ=1,4, cuyo estado final tiene presión P2 = 100 kPa. Determine el trabajo efectuado por el aire sobre el pistón.
Solución
Cuando el índice de politropía se iguala a la constante adiabática, se tiene un proceso en el cual la sustancia de trabajo (el aire) no intercambia calor con el entorno, y por tanto tampoco cambia la entropía.
Para el aire, un gas ideal diatómico, se tiene:
γ = Cp/Cv, con Cp = (7/2)R y Cv = (5/2)R
Entonces:
γ = 7/5 = 1,4
Usando la expresión del proceso politrópico puede determinarse el volumen final del aire:
V2 = [(P2 V11,4)/P2](1/1,4) = 0,54 m3.
Ahora se tienen las condiciones para aplicar la fórmula del trabajo realizado en un proceso politrópico para n≠1 obtenida más arriba:
W = (P2 V2 – P1 V1)/(1-n)
Sustituyendo los valores apropiados se tiene:
W = (100 kPa 0,54 m3 – 400 kPa 0,2 m3)/(1 – 1,4) = 65,4 kJ
Páginas consultadas:

Comentarios
Publicar un comentario